Hablar de rehabilitación en dolor persistente suele invocar ideas de recuperación funcional, readaptación o reaprendizaje del movimiento. Sin embargo, cuando se analiza desde la neurociencia del dolor, la rehabilitación aparece como algo más profundo: una intervención capaz de actuar sobre excitabilidad neuronal, modulación descendente, activación glial y memoria del dolor. Esta entrada desarrolla ese marco en dos territorios clínicos especialmente complejos: el dolor músculo-esquelético persistente y el dolor neuropático.
Cuando este marco se traslada a contextos de alta vulnerabilidad clínica —fragilidad, inmovilidad prolongada, heridas crónicas— el dolor deja de ser un síntoma aislado y se convierte en expresión de una desregulación sistémica. Comprender esta convergencia es clave para no fragmentar el abordaje.
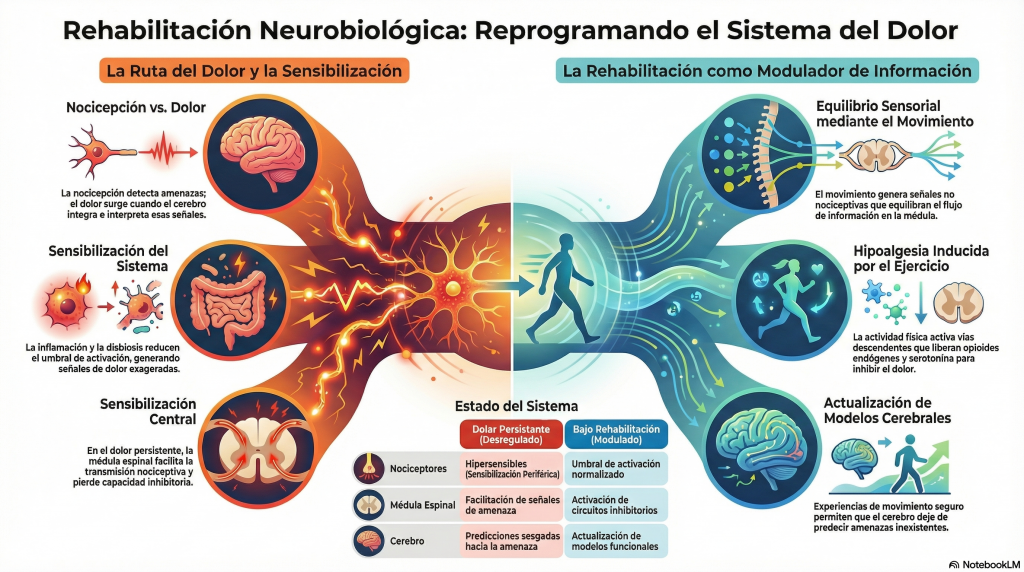
Si en el texto anterior el dolor persistente se ha descrito como un estado aprendido del sistema nervioso, sostenido por cambios duraderos en la excitabilidad neuronal, la neuroinflamación y la memoria funcional de las redes nerviosas, la rehabilitación no puede entenderse como una intervención periférica o accesoria. Desde una perspectiva neurobiológica integradora, la rehabilitación debería constituir una forma de organizar la actividad del sistema nervioso, actuando de manera progresiva y sostenida sobre cómo se genera, se transmite y se modula la información nociceptiva.
Para comprender este papel es necesario detenerse, sin prisa, en el significado de la nocicepción. La nocicepción no es dolor sino el proceso por el que el sistema nervioso detecta estímulos potencialmente amenazantes y los traduce en señales eléctricas y químicas.
Estas señales nacen en nociceptores periféricos —terminaciones nerviosas especializadas— y viajan a través de los axones hacia la médula espinal y el cerebro. El dolor aparece cuando estas señales son integradas, moduladas e interpretadas por el sistema nervioso central. Entre nocicepción y dolor existe, por tanto, un amplio espacio de regulación.
En condiciones fisiológicas, la nocicepción cumple una función protectora. Los nociceptores se activan ante estímulos intensos o lesivos, generan una señal proporcional y esta señal cesa cuando el tejido se recupera.
Cuando el entorno biológico que rodea a estos nociceptores se altera —inflamación persistente, estrés sostenido, cambios metabólicos— el sistema comienza a comportarse de otro modo. Los nociceptores se vuelven más sensibles, responden antes y durante más tiempo, y envían al sistema nervioso central un volumen de información que ya no se corresponde con el estado real del tejido. Este fenómeno se conoce como sensibilización periférica.
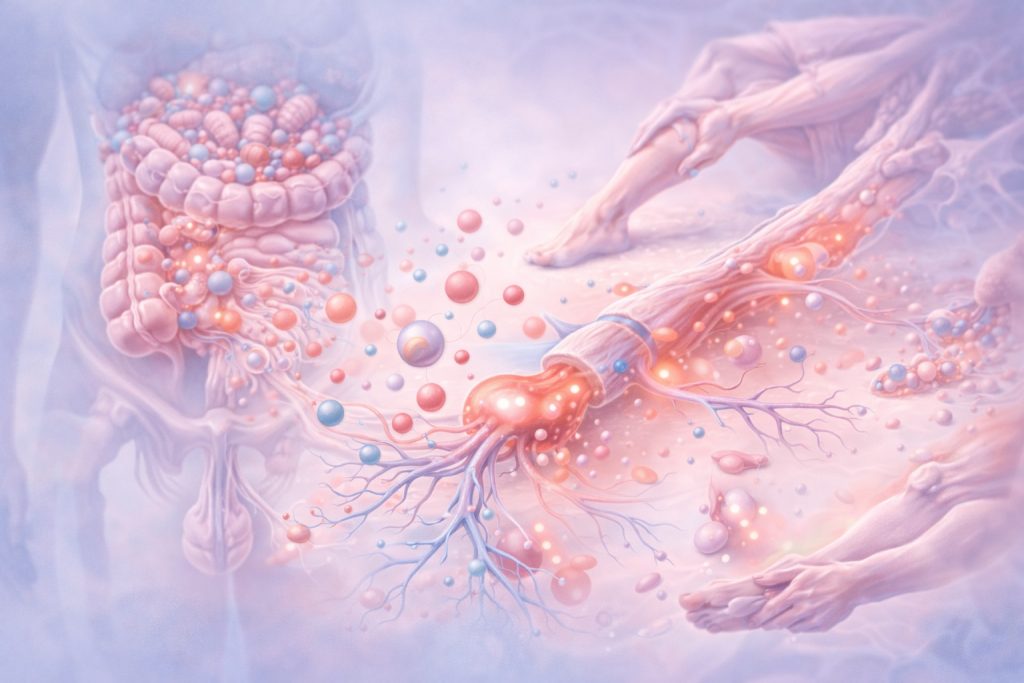
Aquí aparece, de forma natural, la relación con el microbioma. Las alteraciones funcionales del microbioma intestinal no generan dolor directamente, pero modifican el contexto inmunológico y metabólico en el que funcionan los nociceptores.
La disbiosis se asocia a un aumento de citocinas proinflamatorias circulantes y a una activación persistente del sistema inmune innato. Estas señales inflamatorias alcanzan los tejidos periféricos y actúan sobre los nociceptores, reduciendo su umbral de activación. El resultado es que estímulos mecánicos normales —movimiento, carga, estiramiento— comienzan a generar señales nociceptivas exageradas.
La información nociceptiva viaja entonces por los axones aferentes hacia la médula espinal. Este trayecto no es un simple cableado. Los axones nociceptivos, especialmente las fibras C y Aδ, son estructuras dinámicas cuya excitabilidad depende de la distribución de canales iónicos y del estado metabólico de la neurona. En contextos inflamatorios prolongados, estos axones pueden generar actividad espontánea o amplificar señales débiles, contribuyendo a que el sistema nervioso reciba un flujo constante de información de amenaza.
Al llegar al asta dorsal de la médula espinal, la señal nociceptiva entra en un espacio de integración. Aquí convergen aferencias nociceptivas, señales procedentes de mecanorreceptores y propioceptores, y modulaciones descendentes desde el cerebro. En el dolor persistente, este equilibrio se rompe. La transmisión nociceptiva se facilita, las interneuronas inhibitorias pierden eficacia y la señal asciende con mayor facilidad hacia estructuras supraespinales. Este proceso constituye la sensibilización central, un fenómeno que explica por qué el dolor puede mantenerse incluso cuando el input periférico se reduce.
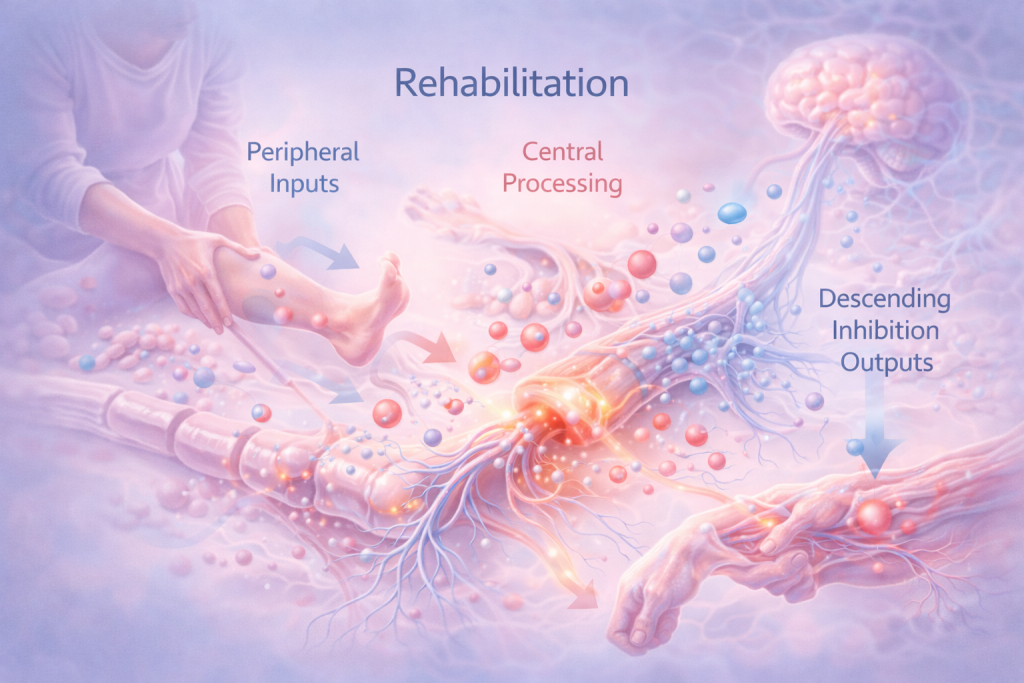
La rehabilitación comienza a actuar precisamente en este punto, no como una corrección brusca, sino como una reintroducción ordenada de información sensorial y motora.
El movimiento, cuando es dosificado, progresivo y contextualizado, genera aferencias no nociceptivas procedentes de músculos, articulaciones y sistemas propioceptivos. Estas aferencias no compiten de forma violenta con el dolor; lo que hacen es equilibrar el paisaje de información que llega a la médula espinal. Allí, favorecen la activación de circuitos inhibitorios y reducen la dominancia de la señal nociceptiva.
Al mismo tiempo, el movimiento influye en niveles superiores del sistema nervioso. El cerebro no es un receptor pasivo de señales periféricas; anticipa, predice y modula lo que espera recibir. En el dolor persistente, estas predicciones suelen estar sesgadas hacia la amenaza. La rehabilitación, al introducir experiencias de movimiento que no confirman esas predicciones catastróficas, permite que el sistema nervioso empiece a actualizar sus modelos internos. Este proceso no es psicológico en un sentido trivial; es neurobiológico, basado en cambios de actividad sináptica y reorganización funcional de redes.
Otro aspecto central de la rehabilitación es su efecto sobre los sistemas descendentes de modulación del dolor. El sistema nervioso dispone de circuitos que pueden amplificar o inhibir la transmisión nociceptiva a nivel medular. Estos circuitos utilizan neurotransmisores como serotonina, noradrenalina, endocannabinoides y opioides endógenos. El movimiento y el ejercicio, incluso a intensidades moderadas, activan preferentemente las vías inhibitorias descendentes, favoreciendo un estado de menor ganancia nociceptiva. Este fenómeno se conoce como hipoalgesia inducida por ejercicio y representa uno de los mecanismos más robustos por los que la rehabilitación modula el dolor.
El microbioma vuelve a intervenir aquí de manera indirecta pero significativa. Los metabolitos microbianos influyen en la disponibilidad de precursores de neurotransmisores y en la regulación del eje hipotálamo-hipófisis-adrenal. Un microbioma funcionalmente equilibrado contribuye a una respuesta al estrés más adaptativa y a una menor activación inflamatoria basal, creando un entorno en el que los sistemas descendentes de inhibición del dolor pueden funcionar con mayor eficacia. Así, la rehabilitación no actúa aislada, sino en diálogo constante con el contexto inmunometabólico del organismo.
En el dolor neuropático, el punto de partida es distinto, pero la lógica integradora se mantiene. La lesión del sistema somatosensorial introduce señales aberrantes que el sistema nervioso no puede ignorar. Sin embargo, incluso en este contexto, la forma en que el cerebro y la médula procesan esa señal no es fija. La rehabilitación no elimina la lesión, pero organiza la respuesta del sistema nervioso frente a ella, limitando la amplificación central y favoreciendo formas de reorganización funcional más adaptativas.
Desde esta perspectiva, la rehabilitación no se define por una técnica concreta, sino por su capacidad para modular flujos de información. Modula inputs periféricos, reorganiza el procesamiento central y favorece outputs descendentes inhibitorios. Al hacerlo, interviene sobre los mismos mecanismos que sostienen la memoria del dolor, no para borrarla de golpe, sino para permitir que el sistema nervioso recupere gradualmente su capacidad de discriminación y adaptación.
Entendida así, la rehabilitación no es una intervención menor ni tardía. Es una forma de diálogo continuo con un sistema nervioso que ha aprendido a doler, ofreciendo nuevas experiencias sensoriales y motoras que, repetidas en el tiempo, pueden debilitar la huella del dolor persistente y abrir espacio a estados funcionales menos reactivos.
Cuando este marco se traslada a contextos de alta vulnerabilidad clínica —fragilidad, inmovilidad prolongada, heridas crónicas— el dolor deja de ser un síntoma aislado y se convierte en expresión de una desregulación sistémica. Comprender esta convergencia es clave para no fragmentar el abordaje.
Referencias
- Woolf CJ. Central sensitization: implications for the diagnosis and treatment of pain. Pain. 2011;152(3 Suppl):S2-S15.
- Latremoliere A, Woolf CJ. Central sensitization: a generator of pain hypersensitivity by central neural plasticity. J Pain. 2009;10(9):895-926.
- Ji RR, Nackley A, Huh Y, Terrando N, Maixner W. Neuroinflammation and central sensitization in chronic pain. Annu Rev Neurosci. 2018;41:459-486.
- Rice D, Nijs J, Kosek E, et al. Exercise-induced hypoalgesia in pain-free and chronic pain populations. J Pain. 2019;20(11):1249-1266.
- Koltyn KF. Mechanisms of exercise-induced hypoalgesia. J Pain. 2014;15(12):1294-1304.
- Treede RD, Jensen TS, Campbell JN, et al. Neuropathic pain: redefinition and grading system. Pain. 2008;137(3):491-502.
- Ji RR, Donnelly CR, Nedergaard M. Astrocytes in chronic pain and itch. Nat Rev Neurosci. 2019;20:667-685.
- Mayer EA. Gut/brain axis and the microbiota. J Clin Invest. 2015;125(3):926-938