Hay contextos clínicos en los que el dolor deja de ser un síntoma aislado para convertirse en un lenguaje persistente del sistema. La fragilidad, la inmovilidad y las heridas crónicas conforman uno de esos escenarios en los que el cuerpo ya no dispone de margen suficiente para amortiguar el estrés biológico acumulado. En ellos, el dolor no puede explicarse únicamente por la lesión visible ni por la duración del proceso, sino por la convergencia de múltiples pérdidas de regulación: inflamatoria, neurológica, metabólica y sensorial.
En estas situaciones, el sistema nervioso no responde desde la alarma aguda, sino desde un estado prolongado de adaptación forzada. El dolor emerge entonces como una propiedad del conjunto, sostenido por la interacción entre inflamación persistente, desuso, alteraciones del eje del estrés y reorganización funcional de los circuitos nociceptivos. Comprender este marco es esencial para evitar abordajes fragmentados y para situar la rehabilitación, el cuidado de las heridas y la lectura biológica del paciente dentro de una misma lógica clínica.
Cuando el dolor persistente aparece en contextos de fragilidad, inmovilidad y heridas crónicas, deja de ser un fenómeno aislado para convertirse en una manifestación integrada de un sistema biológico sometido a estrés continuado. En estos escenarios, el dolor no puede entenderse únicamente como una consecuencia directa del daño tisular ni como una alteración puntual del sistema nervioso, sino como la expresión de una pérdida progresiva de capacidad adaptativa, en la que confluyen inflamación sostenida, desuso, alteraciones neuroendocrinas y reorganización funcional del sistema nervioso central.
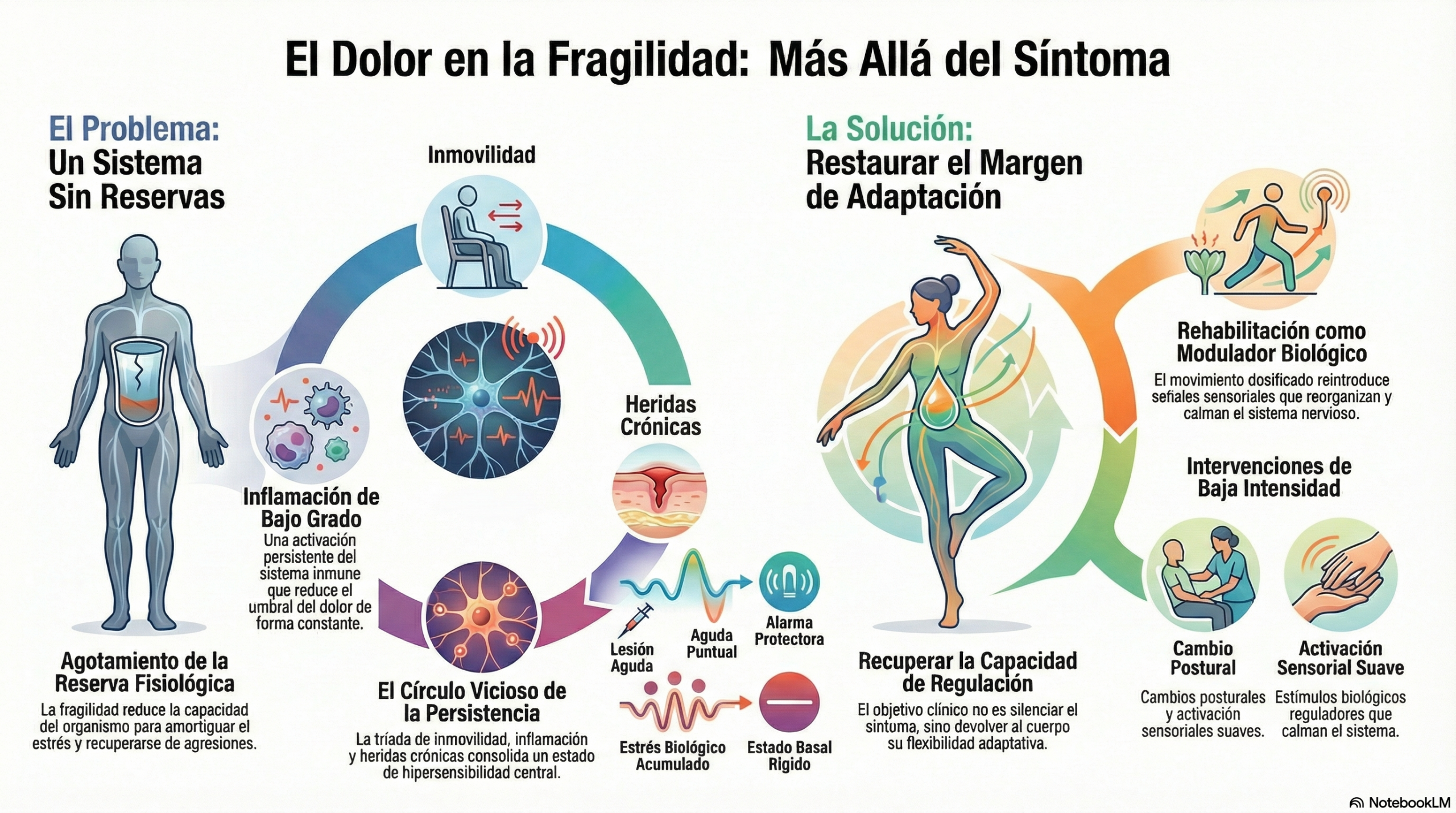
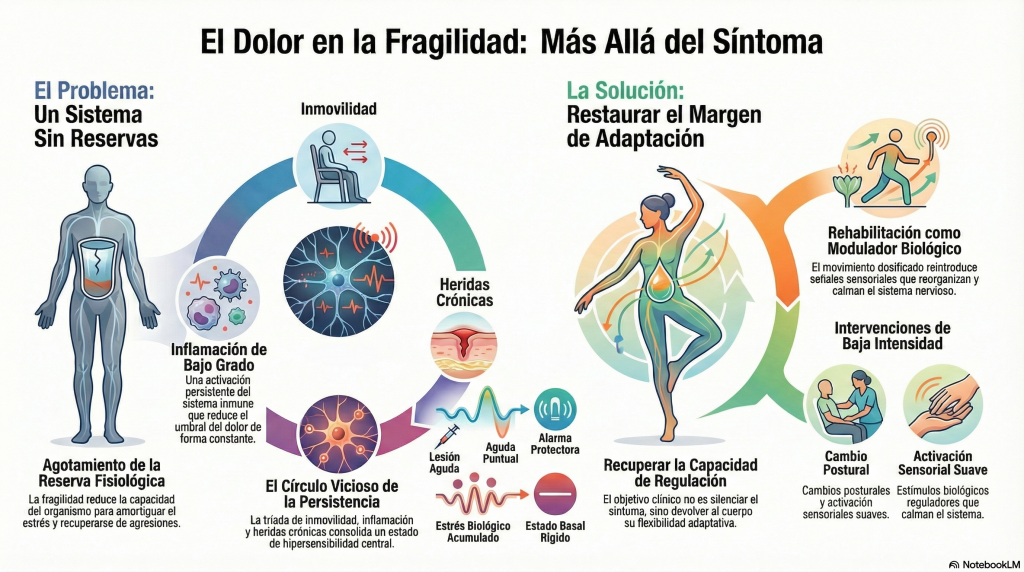
La fragilidad, desde una perspectiva biológica, no se define solo por la edad ni por la suma de diagnósticos, sino por la reducción de la reserva fisiológica que permite al organismo responder y recuperarse ante una agresión. Esta pérdida de reserva afecta de forma simultánea al sistema musculoesquelético, al sistema inmunitario, al metabolismo energético y al sistema nervioso. Cuando esta reserva disminuye, estímulos que antes eran bien tolerados —una herida, un periodo breve de inmovilización, un episodio inflamatorio— generan respuestas desproporcionadas y difíciles de apagar. El dolor persistente se inscribe precisamente en este terreno.
En la fragilidad avanzada, el organismo suele mostrar signos de un estado inflamatorio de bajo grado mantenido en el tiempo. No se trata de infecciones activas ni de inflamación aguda evidente, sino de una activación persistente del sistema inmune que se refleja en marcadores biológicos discretamente alterados y, sobre todo, en la incapacidad del sistema para volver a un estado basal. Este trasfondo inflamatorio condiciona la excitabilidad del sistema nervioso, reduce el umbral nociceptivo y favorece que el dolor se convierta en un estado basal más que en una respuesta puntual.
La inmovilidad, frecuente en personas frágiles o con heridas crónicas, actúa como un amplificador silencioso de este proceso. El movimiento no es únicamente una función mecánica; constituye una fuente constante de información sensorial y propioceptiva que regula el sistema nervioso. Cuando el movimiento se reduce de forma prolongada, el sistema nervioso pierde una de sus principales señales moduladoras. En su ausencia, las señales inflamatorias, metabólicas y de estrés adquieren un peso desproporcionado en la organización del sistema.
Desde el punto de vista neurobiológico, la inmovilidad empobrece el flujo de aferencias reguladoras hacia la médula espinal y el cerebro. Esta reducción de inputs no nociceptivos favorece que la señal nociceptiva, procedente de tejidos inflamados o lesionados, domine el procesamiento central. Con el tiempo, el sistema nervioso se reorganiza en torno a esa señal dominante, consolidando estados de hipersensibilidad y reduciendo la eficacia de los mecanismos inhibitorios descendentes del dolor.
En este contexto, las heridas crónicas representan un estímulo particularmente potente. La herida crónica no es solo una lesión cutánea que no cicatriza; es un foco inflamatorio persistente que mantiene activados nociceptores periféricos y sistemas inmunitarios locales. La piel, como órgano sensorial e inmunológico, está íntimamente conectada con el sistema nervioso. La inflamación sostenida del lecho de la herida genera un flujo continuo de información nociceptiva hacia la médula espinal, alimentando procesos de sensibilización central.
Este input persistente no actúa sobre un sistema neutro. Llega a un sistema nervioso condicionado por la fragilidad, la inmovilidad y el estrés fisiológico acumulado. A nivel central, la microglía y los astrocitos, expuestos de forma prolongada a señales inflamatorias periféricas y centrales, adoptan estados reactivos que amplifican la transmisión nociceptiva. El dolor deja entonces de cumplir una función protectora clara y pasa a formar parte del estado basal del sistema nervioso.
El microbioma intestinal se integra en este escenario como modulador del terreno biológico sobre el que se desarrollan estos procesos. La fragilidad, la inmovilidad y la polifarmacia frecuentes en estos pacientes se asocian con alteraciones funcionales del microbioma, que a su vez favorecen un aumento de la inflamación sistémica y una menor capacidad de resolución inflamatoria. Este entorno inmunometabólico influye tanto en la cicatrización de las heridas como en la excitabilidad del sistema nervioso, cerrando un círculo en el que inflamación periférica y central se refuerzan mutuamente.
Desde el punto de vista neuroendocrino, estos pacientes suelen mostrar signos de una respuesta al estrés mantenida y poco flexible. La activación prolongada del eje hipotálamo-hipófisis-adrenal, inicialmente adaptativa, acaba perdiendo eficacia reguladora. El sistema produce señales hormonales de estrés, pero los tejidos —incluido el sistema nervioso— responden cada vez peor a ellas. Este desacoplamiento contribuye a la persistencia de la inflamación, al agotamiento energético y a la dificultad para modular el dolor.
Los biomarcadores, en este contexto, no funcionan como diagnósticos aislados, sino como indicadores de un sistema que ha perdido capacidad de regulación. Marcadores de inflamación sistémica discretamente elevados, alteraciones del ritmo hormonal del estrés, signos de desnutrición proteica o de deterioro metabólico no explican por sí solos el dolor, pero ayudan a comprender por qué el sistema nervioso permanece atrapado en un estado de alerta. Son la expresión medible de procesos que el clínico ya percibe en la evolución lenta, en la hipersensibilidad al movimiento y en la dificultad para romper el círculo de dolor e inmovilidad.
En este escenario, la rehabilitación adquiere un significado que va más allá de la recuperación funcional clásica. No se trata únicamente de fortalecer músculos o mejorar rangos articulares, sino de reintroducir información organizada en un sistema empobrecido de señales reguladoras. Incluso intervenciones de baja intensidad —movilizaciones suaves, cambios posturales, activación sensorial dosificada— pueden actuar como estímulos biológicos capaces de modular la excitabilidad del sistema nervioso y reducir la ganancia nociceptiva.
La rehabilitación, integrada en el cuidado de las heridas y adaptada a la capacidad real de la persona frágil, actúa como un modulador sistémico. Contribuye a mejorar el entorno metabólico, a reducir el tono inflamatorio basal y a favorecer una organización más flexible de los circuitos nerviosos. Estos cambios no siempre se traducen de inmediato en una reducción del dolor percibido, pero suelen reflejarse antes en una mayor tolerancia al movimiento, en una mejor respuesta al tratamiento local de la herida y en una progresiva normalización de los parámetros biológicos que indican que el sistema comienza a salir del estado de alerta permanente.
Desde esta mirada integrada, tratar el dolor en la fragilidad no implica perseguir la eliminación completa del síntoma, sino restaurar margen de adaptación. Cada intervención que reduce la inmovilidad, que modula la inflamación o que mejora el entorno sensorial y metabólico del sistema nervioso contribuye a debilitar la memoria del dolor. El objetivo no es silenciar al sistema, sino ayudarlo a recuperar su capacidad de discriminar, regular y responder de forma proporcionada.
Entendido así, el dolor en personas frágiles con heridas crónicas no es un destino inevitable ni un ruido de fondo que deba asumirse. Es la señal de un sistema que ha sido exigido más allá de su reserva. Integrar el cuidado de las heridas, la rehabilitación y la lectura biológica de los procesos subyacentes permite ofrecer intervenciones más coherentes, más humanas y, sobre todo, más alineadas con la complejidad real de estos pacientes.
A lo largo de estas tres entradas se ha desarrollado una idea central: el dolor persistente no es un fenómeno localizado ni un fallo del sistema, sino el resultado de procesos adaptativos que se han vuelto rígidos. Desde la modulación basal que ejerce el microbioma sobre la inflamación y la excitabilidad neuronal, pasando por la organización funcional de la nocicepción y la plasticidad del sistema nervioso, hasta los escenarios de fragilidad y heridas crónicas, el dolor aparece como una expresión coherente de un sistema sometido a estrés continuado.
Esta mirada obliga a desplazar el foco. No se trata de buscar una causa única ni de intervenir sobre un solo nivel, sino de entender cómo diferentes sistemas —nervioso, inmune, endocrino y musculoesquelético— dialogan entre sí y condicionan la experiencia dolorosa. En este diálogo, los biomarcadores no son etiquetas diagnósticas, sino indicadores de estado, y la rehabilitación no es una técnica añadida, sino una forma de reorganizar la información que recibe y procesa el sistema nervioso.
Integrar microbioma, nocicepción, glía, movimiento y contexto biológico no significa complejizar innecesariamente la clínica, sino hacerla más honesta con la realidad del paciente. Especialmente en los escenarios de fragilidad, el objetivo no es silenciar el dolor de forma inmediata, sino devolver al sistema capacidad de regulación, margen de adaptación y posibilidad de reorganización.
Esta trilogía no propone recetas ni protocolos cerrados. Propone un marco para pensar el dolor persistente sin reducirlo, sin banalizarlo y sin separar artificialmente aquello que, en el cuerpo real, funciona de forma inseparable. Pensar el dolor desde aquí no garantiza soluciones rápidas, pero sí intervenciones más coherentes, más humanas y más alineadas con la complejidad biológica de quienes conviven con él.
Referencias
- Woolf CJ. Central sensitization: implications for the diagnosis and treatment of pain. Pain. 2011;152(3 Suppl):S2-S15.
- Ji RR, Nackley A, Huh Y, Terrando N, Maixner W. Neuroinflammation and central sensitization in chronic and widespread pain. Annu Rev Neurosci. 2018;41:459-486.
- Mayer EA. Gut/brain axis and the microbiota. J Clin Invest. 2015;125(3):926-938.
- Martin CR, Osadchiy V, Kalani A, Mayer EA. The brain-gut-microbiome axis. Cell Host Microbe. 2018;23(5):651-664.
- Sluka KA, Clauw DJ. Neurobiology of fibromyalgia and chronic widespread pain. Neuroscience. 2016;338:114-129.
- Kehlet H, Jensen TS, Woolf CJ. Persistent postsurgical pain: risk factors and prevention. Lancet. 2006;367(9522):1618-1625.
- Varela E, Kinnaird T, Kroll MH. Inflammation and wound healing: the role of the immune system. J Leukoc Biol. 2019;106(2):355-367.
- Nijs J, George SZ, Clauw DJ, et al. Central sensitisation in chronic pain conditions: latest discoveries and their potential for precision medicine. Lancet Rheumatol. 2021;3(6):e383-e392.