Dolor persistente, neuroplasticidad, rehabilitación y cuidado enfermero: cuando el síntoma deja de ser epifenómeno
«Todo hombre puede ser, si se lo propone, escultor de su propio cerebro.»
Santiago Ramón y Cajal
La frase de Santiago Ramón y Cajal ha sido repetida durante décadas hasta el desgaste. Se la ha convertido en lema de superación, en metáfora de la voluntad o en consigna pedagógica.
Sin embargo, leída desde la neurociencia contemporánea, esta afirmación no habla de actitud ni de moral. Habla de biología. Habla de un sistema nervioso que cambia, que se reorganiza, que aprende. Habla de neuroplasticidad. Y es precisamente esa capacidad de cambio —esa plasticidad— la que permite comprender algo que durante mucho tiempo ha resultado incómodo para la medicina: que el dolor puede convertirse en una enfermedad en sí misma, independiente del daño tisular que pudo originarlo, sostenida por mecanismos neurobiológicos propios y profundamente modulada por el aprendizaje, el contexto, la historia corporal y el significado.
El mismo principio que permite la recuperación tras una lesión neurológica, la adaptación al entorno o el aprendizaje motor explica también la cronificación del sufrimiento. No hay dos plasticidades: hay una sola, con direcciones distintas.
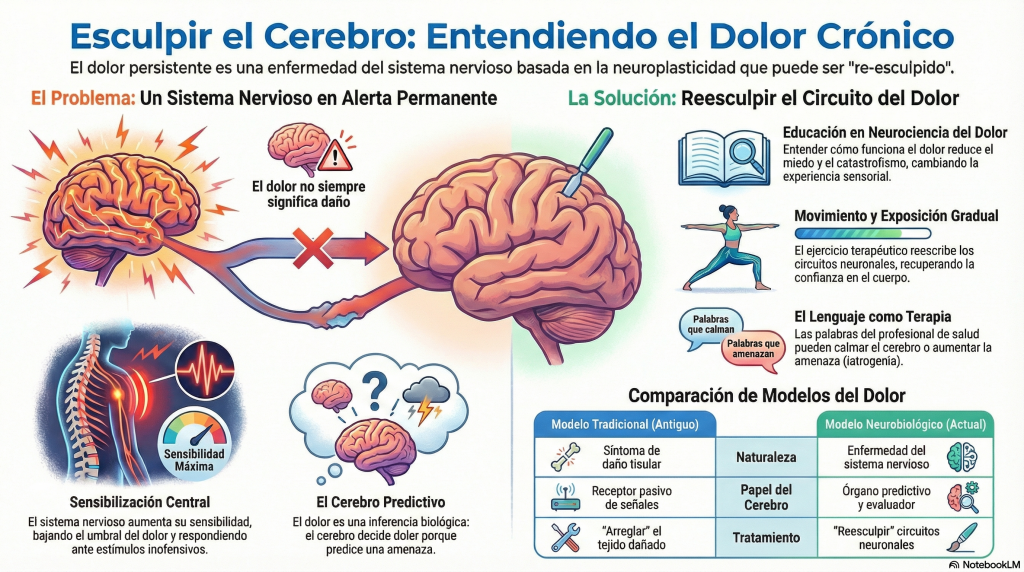
Durante buena parte del siglo XX, el dolor fue conceptualizado casi exclusivamente como un síntoma, un epifenómeno del daño tisular, proporcional a la lesión y con una función protectora clara. En ese marco, el dolor era entendido como una consecuencia secundaria, subordinada y dependiente de un proceso considerado principal: la lesión del tejido.
Esta concepción establecía una jerarquía aparentemente lógica: primero estaba la lesión; después, como un reflejo fiel, aparecía el dolor. Si la lesión sanaba, el dolor debía desaparecer. Si el dolor persistía, se asumía que algo no estaba bien medido, bien diagnosticado o bien interpretado. El modelo no contemplaba que el dolor pudiera emanciparse del tejido y convertirse en el problema central.
Cuando hablamos de epifenómeno en el contexto del dolor, nos referimos a la idea, históricamente dominante, de que el dolor era un efecto secundario del daño tisular, dependiente y subordinado a la lesión. Esto no significaba que el dolor no fuera real, sino que no tenía entidad propia dentro del modelo explicativo. Hoy sabemos que este enfoque es insuficiente: en muchos casos, el dolor persistente no es un efecto colateral de otra enfermedad, sino una enfermedad del sistema nervioso en sí misma.
Este marco conceptual ha tenido consecuencias clínicas profundas. Al considerar el dolor únicamente como epifenómeno, la atención se centró casi exclusivamente en el tejido. Cuando el tejido “estaba bien”, el dolor quedaba sin explicación. Y cuando algo no se explica, se desplaza: hacia lo psicológico mal entendido, hacia la sospecha de exageración, hacia el cuestionamiento del paciente. La evidencia científica ha desmontado progresivamente esta visión reduccionista.
En 2020, la International Association for the Study of Pain redefinió el dolor como una experiencia sensorial y emocional desagradable asociada o similar a la asociada con daño tisular real o potencial, subrayando explícitamente que el dolor puede existir sin daño tisular identificable (Raja et al., 2020) [1].
Esta definición reconoce que el dolor no es un mero reflejo periférico, sino una experiencia compleja, emergente y modulada centralmente. Este giro conceptual se consolidó con la inclusión del dolor crónico primario como entidad diagnóstica independiente en la ICD-11, definiéndolo como una enfermedad en sí misma y no como un síntoma secundario de otra patología (Treede et al., 2019) [2].
Esta clasificación incluye entidades como la fibromialgia, el dolor lumbar crónico inespecífico o el dolor musculoesquelético generalizado. Aceptar esta definición implica asumir algo incómodo para la práctica clínica tradicional: en muchos casos, el problema no está en el tejido, sino en el sistema nervioso.
La investigación en neuroimagen funcional y estructural ha aportado evidencia sólida en este sentido. Apkarian y colaboradores demostraron que las personas con dolor crónico presentan alteraciones consistentes en regiones cerebrales implicadas en la evaluación emocional, la motivación, la toma de decisiones y la anticipación —como la corteza prefrontal medial, la ínsula y el cíngulo anterior— más que en áreas puramente sensoriales (Apkarian et al., 2004; Apkarian et al., 2011) [3,4].
Estos hallazgos muestran que el dolor persistente no es solo una señal nociceptiva mantenida, sino un estado cerebral reorganizado hacia redes de saliencia y amenaza. El cerebro aprende a prestar atención al cuerpo de una manera distinta. De forma complementaria, Flor y su grupo demostraron reorganización de la corteza somatosensorial primaria en distintos síndromes de dolor persistente, evidenciando que la representación cortical del cuerpo se distorsiona cuando el dolor se mantiene en el tiempo (Flor, 2012) [5]. El cuerpo que duele deja de ser representado como neutral: se convierte en territorio potencialmente peligroso.
A estos cambios se suma el fenómeno de la sensibilización central, descrito por Woolf como un estado de hiperexcitabilidad del sistema nervioso central en el que se amplifica la respuesta a estímulos nociceptivos y no nociceptivos, y se reduce la eficacia de los mecanismos inhibitorios descendentes (Woolf, 2011) [6].
La sensibilización central no significa que la persona sea más sensible ni menos tolerante. Significa que el sistema nervioso ha cambiado su forma de responder. El umbral del dolor desciende, la ganancia del sistema aumenta y los mecanismos de filtrado inhibitorio pierden eficacia. El cuerpo se interpreta desde la alerta, no desde la seguridad.
Este estado explica fenómenos clínicos frecuentes: hiperalgesia, alodinia, dolor desproporcionado, dolor generalizado. No se trata de exageración ni de fragilidad emocional. Se trata de neurofisiología. Todo esto no es psicológico en el sentido trivial del término. Es neurobiología. Es plasticidad. La plasticidad que permite aprender permite también cronificar. El sistema nervioso aprende a proteger en exceso. Aprende a interpretar el mundo corporal como amenazante. Aprende a responder con dolor incluso cuando el daño ya no está presente.
Los modelos contemporáneos de procesamiento predictivo ofrecen un marco integrador para comprender estos fenómenos. Desde la teoría del cerebro bayesiano, el cerebro no actúa como un receptor pasivo de información sensorial, sino como un órgano predictivo que formula constantemente hipótesis sobre el estado del cuerpo y del entorno (Friston, 2010) [7].
El dolor emerge cuando el cerebro predice que existe una amenaza suficiente para justificar una respuesta protectora. Esa predicción se basa en señales sensoriales, pero también en experiencias previas, aprendizaje, contexto y significado. Decir que el dolor es una inferencia no implica que sea imaginado ni voluntario. Implica que es una decisión biológica automática.
Cuando decimos que el dolor es una inferencia, no estamos diciendo que sea imaginado. Inferir es decidir biológicamente. El cerebro no espera pasivamente a que el daño ocurra: predice. El dolor aparece cuando el cerebro concluye que proteger es más seguro que no hacerlo.
Wiech y otros autores han demostrado que las expectativas y el contexto modulan de forma decisiva la percepción dolorosa, a veces más que la intensidad del estímulo nociceptivo (Wiech, 2016) [8]. Büchel y colaboradores aplicaron este marco a la analgesia placebo, mostrando que la modulación del dolor puede entenderse como una actualización de predicciones cerebrales más que como una simple inhibición periférica (Büchel et al., 2014) [9].
Este marco teórico sustenta la educación en neurociencia del dolor, conocida como Pain Neuroscience Education o Explain the Pain. Desarrollada por Butler y Moseley, esta intervención parte de una premisa clara: comprender cómo funciona el dolor cambia la experiencia del dolor.
Moseley demostró que explicar a las personas con dolor crónico los mecanismos neurobiológicos implicados reduce el catastrofismo, el miedo al movimiento y la discapacidad funcional, incluso cuando la intensidad del dolor no disminuye de forma inmediata (Moseley, 2004; Moseley, 2012) [10,11].
Metaanálisis posteriores confirmaron que esta educación es especialmente eficaz cuando se integra en programas de rehabilitación activa y ejercicio terapéutico, y no como intervención aislada y pasiva (Louw et al., 2016; Louw et al., 2020) [12–14].
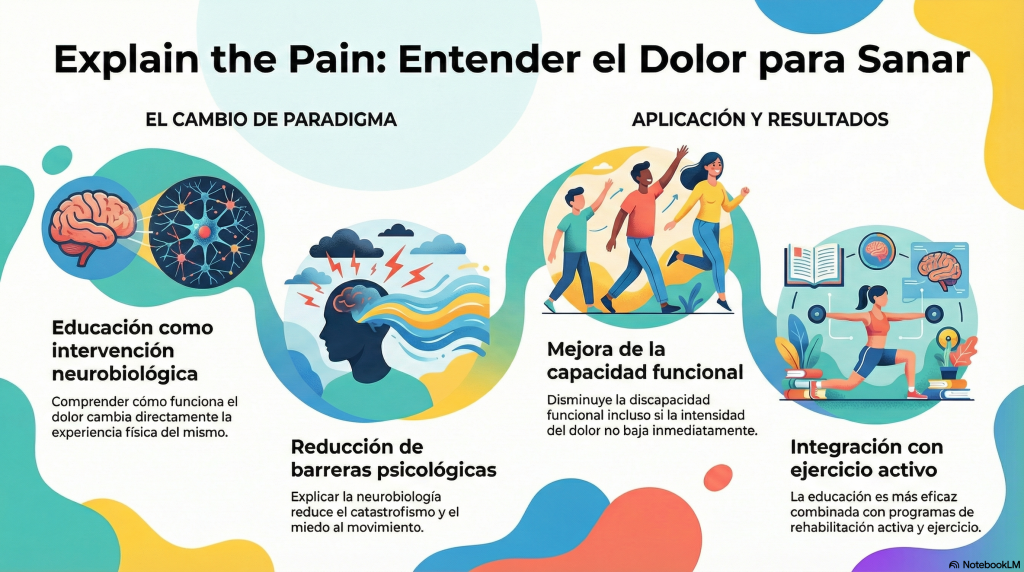
Explicar el dolor desde la neurociencia no le quita realidad. Se la devuelve. Porque deja de ser un misterio culpabilizante y pasa a ser un proceso comprensible, modificable y tratable.
Desde esta perspectiva, la rehabilitación no consiste en “arreglar” tejidos, sino en reesculpir circuitos neuronales. El ejercicio terapéutico, avalado por revisiones sistemáticas como la de Geneen et al. (2017), reduce dolor y discapacidad en múltiples condiciones de dolor crónico, fundamentalmente a través de mecanismos centrales (Geneen et al., 2017) [15]. El modelo de evitación por miedo explica cómo la evitación sistemática del movimiento perpetúa la discapacidad, mientras que la exposición progresiva y segura permite recuperar función y confianza (Vlaeyen y Linton, 2012) [16].
En todo este proceso, el papel de la enfermera es estructural. La enfermería no es un complemento técnico, sino un agente activo de modulación neurobiológica. La evidencia internacional subraya la importancia de la educación terapéutica, la continuidad asistencial y el cuidado centrado en la persona en el manejo del dolor crónico.
La enfermera observa la evolución real del dolor, detecta patrones de miedo, interpreta el contexto, modula mensajes y evita iatrogenia comunicativa. Cada interacción es una oportunidad de aprendizaje neural. Cada explicación coherente, cada movilización sin amenaza innecesaria, cada intervención que valida el dolor sin reforzar la catástrofe contribuye a generar neuroplasticidad adaptativa.
Hay todavía una capa más que resulta imprescindible cuando se habla de dolor como enfermedad del sistema nervioso, y es la del lenguaje clínico, la comunicación sanitaria y la identidad corporal.
El sistema nervioso no aprende solo de estímulos físicos o de experiencias directas; aprende también —y de forma muy potente— de los mensajes que recibe, de las palabras que se utilizan para nombrar el cuerpo, del modo en que se explica el diagnóstico y de los silencios que se dejan cuando no se sabe qué decir.
El lenguaje no es un vehículo neutro. En el contexto del dolor persistente, el lenguaje es contexto neurobiológico.
La iatrogenia comunicativa existe. Mensajes alarmistas, imprecisos o catastrofistas aumentan la percepción de amenaza y pueden favorecer la cronificación del dolor. Cuidar las palabras también es una intervención terapéutica.
La iatrogenia comunicativa no siempre es explícita. A veces adopta la forma de frases vagas, de explicaciones incompletas o de silencios que el paciente rellena con miedo. Otras veces aparece cuando se transmite un mensaje aparentemente tranquilizador —“no tienes nada”— sin ofrecer un modelo explicativo alternativo. En ausencia de explicación, el cerebro no se calma: imagina.
Y suele imaginar lo peor. Aquí se produce un fenómeno especialmente relevante: el dolor persistente empieza a formar parte de la identidad corporal de la persona. El cuerpo deja de ser un medio y pasa a ser un problema. La atención se fija en él, la confianza se erosiona y la vida se organiza en torno a evitar el dolor.
Este proceso se manifiesta en conductas de evitación, en hipervigilancia corporal, en miedo al movimiento y en una reducción progresiva del repertorio vital.
El modelo de evitación por miedo descrito por Vlaeyen y Linton explica cómo estas conductas, lejos de proteger, perpetúan el dolor y la discapacidad (Vlaeyen y Linton, 2012) [16].
En este punto, el cuidado sanitario —y muy especialmente el cuidado enfermero— adquiere una dimensión que va mucho más allá de la técnica. La enfermera no solo ejecuta intervenciones; co-construye significado. Está presente en el tiempo, observa la evolución real del dolor y tiene la posibilidad de intervenir justo en el lugar donde el sistema nervioso está aprendiendo.
Desde esta perspectiva, cuidar no es solo aliviar. Cuidar es modificar predicciones. Y modificar predicciones es, literalmente, esculpir el cerebro que duele.
Volver a Cajal, más de un siglo después, no es un gesto erudito. Es reconocer que el dolor persistente es, en gran medida, una consecuencia de la plasticidad cerebral, y que la rehabilitación, la educación y el cuidado son herramientas legítimas para transformarla. El dolor no se combate contra el cuerpo. Se trabaja con el cerebro. Y en ese trabajo lento, reiterativo y profundamente humano, la enfermería no acompaña desde los márgenes: interviene en el núcleo mismo del proceso.
Referencias
- Raja SN, Carr DB, Cohen M, Finnerup NB, Flor H, Gibson S, et al. The revised International Association for the Study of Pain definition of pain. Pain. 2020;161(9):1976–82.
- Treede RD, Rief W, Barke A, Aziz Q, Bennett MI, Benoliel R, et al. Chronic pain as a symptom or a disease: the IASP Classification of Chronic Pain for the ICD-11. Pain. 2019;160(1):19–27.
- Apkarian AV, Sosa Y, Sonty S, Levy RM, Harden RN, Parrish TB, et al. Chronic pain patients are impaired on an emotional decision-making task. J Neurosci. 2004;24(47):10410–5.
- Apkarian AV, Hashmi JA, Baliki MN. Pain and the brain: specificity and plasticity of the brain in clinical chronic pain. Pain. 2011;152(3 Suppl):S49–64.
- Flor H. New developments in the understanding and management of persistent pain. Nat Rev Neurosci. 2012;13(7):517–26.
- Woolf CJ. Central sensitization: implications for the diagnosis and treatment of pain. Pain. 2011;152(3 Suppl):S2–15.
- Friston K. The free-energy principle: a unified brain theory? Nat Rev Neurosci. 2010;11(2):127–38.
- Wiech K. Deconstructing the sensation of pain: the influence of cognitive processes on pain perception. Science. 2016;354(6312):584–7.
- Büchel C, Geuter S, Sprenger C, Eippert F. Placebo analgesia: a predictive coding perspective. Neuron. 2014;81(6):1223–39.
- Moseley GL. Evidence for a direct relationship between cognitive and physical change during an education intervention in people with chronic low back pain. Eur J Pain. 2004;8(1):39–45.
- Moseley GL. Teaching people about pain: why do we keep beating around the bush? Pain. 2012;153(4):763–4.
- Louw A, Diener I, Butler DS, Puentedura EJ. The effect of neuroscience education on pain, disability, anxiety, and stress in chronic musculoskeletal pain. Spine. 2011;36(21):E1417–28.
- Louw A, Zimney K, Puentedura EJ, Diener I. The efficacy of pain neuroscience education on musculoskeletal pain: a systematic review of the literature. Phys Ther. 2016;96(6):1027–40.
- Louw A, Puentedura EJ, Zimney K, Schmidt S. Know pain, know gain? A perspective on pain neuroscience education in manual therapy. J Orthop Sports Phys Ther. 2016;46(3):131–4.
- Geneen LJ, Moore RA, Clarke C, Martin D, Colvin LA, Smith BH. Physical activity and exercise for chronic pain in adults: an overview of Cochrane Reviews. Cochrane Database Syst Rev. 2017;(4):CD011279.
- Vlaeyen JWS, Linton SJ. Fear-avoidance model of chronic pain: an update. Pain. 2012;153(6):1144–7.